
尽管在2021年12月欧盟发布公告IVDR实施日期延期,但是对于A类产品,仍必须在2022年5月26日之前以Self-declaration符合(EU)2017/746才可进入欧盟市场,A类产品欧盟注册迫在眉睫。
IVDR新法规增加了很多全新的要求,包括产品分类,唯一器械标识(UDI),CE相关认证方(制造商、欧盟授权代表、经销商等)在欧盟注册要求,性能评估及上市性能跟踪要求,上市后市场监督要求等。对于生产商来说,提高了欧盟市场的准入门槛,并且对其监管更加严格,给制造商带来极大的挑战。
明德生物紧锣密鼓地开展了法规跟踪与实施工作,按照IVDR法规要求,完善产品性能,完成产品技术文档及体系升级,4款产品:Disposable virus sampling tube (一次性病毒采样管),Sample release Reagent(样本释放剂),Full-Automatic Nucleic acid Extraction and Purification Instrument (全自动核酸提取纯化仪)及Nucleic Acid (DNA/RNA) Extraction Kit(核酸提取试剂)已于2022年3月18日通过了欧盟IVDR注册。 附注册确认部分截图: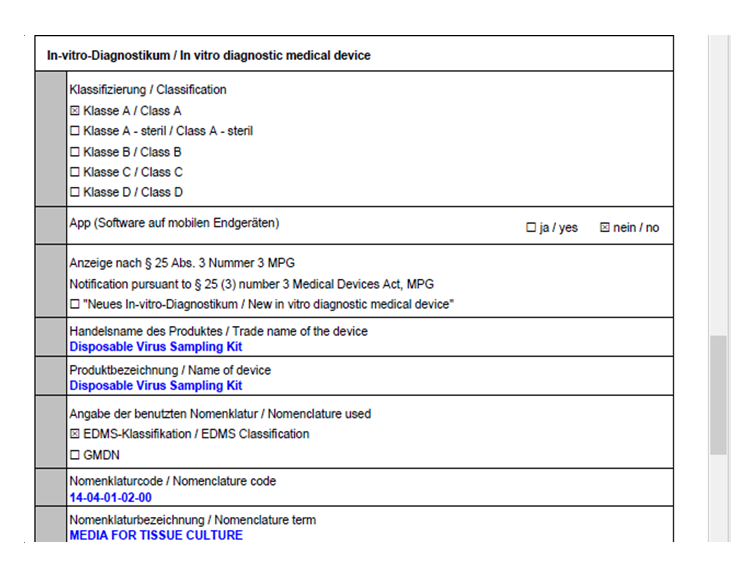
TEL:027-87808005

Copyright © 2024 武汉明德生物科技股份有限公司版权 | 鄂ICP备12000100
互联网药品信息服务资格证书 [(鄂)-非经营性-2016-0005]
 鄂公网安备 42011502000634
鄂公网安备 42011502000634
