
肺炎疫情牵动全国人民的心,作为一家有责任的IVD企业,最大的贡献就是尽快研发出针对病毒诊断的试剂,提供病毒检测解决方案,加大生产,投放一线帮助医生诊断病患。
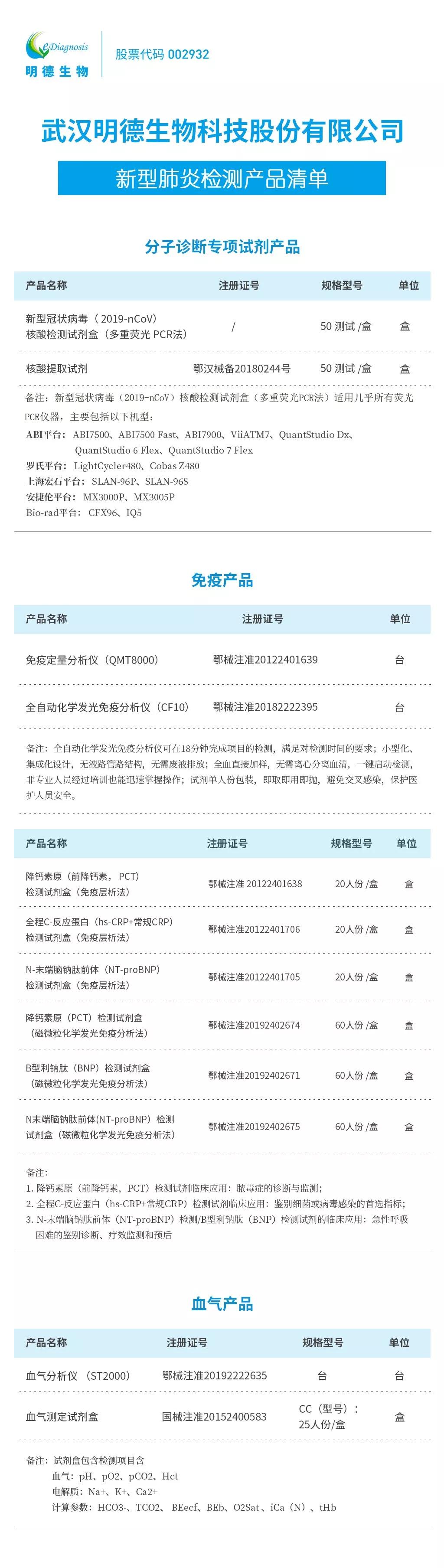
明德生物成功研发出“新型冠状病毒(2019-nCoV)核酸检测试剂盒”并投入疫情一线使用
作为武汉本土的IVD企业,明德更是倍感责任重大。在春节期间公司研发人员彻夜研发,成功研制出“新型冠状病毒(2019-nCoV)核酸检测试剂盒”。目前已经实现向疫情一线供货使用(义不容辞!明德生物捐赠10000人份新冠病毒试剂盒给湖北省医疗机构!),尽最大努力满足各级医疗机构在特殊时期、特殊背景下的检测试剂需求。



明德生物将推出分子诊断POCT 助力新冠病毒现场快速检测
明德生物新型冠状病毒(2019-nCoV)POCT检测试剂盒基于明德生物自有的POCT分子诊断技术平台开发,采用一步式多重快速荧光PCR技术,对新型冠状病毒ORF1ab与编码核衣壳蛋白N基因中特异性保守序列进行快速检测,用于对2019新型冠状病毒感染疑似病例、疑似聚集性病例及其他需要提供快速辅助诊断方案。
该设备高度集成化,仪器小巧、快速且便携,30分钟出结果,可在社区服务中心、二级医院以及三级医院发热门诊现场使用。
明德生物已有多个产品辅助新冠肺炎诊断!
1月28日,国家卫健委发布《新型冠状病毒感染的肺炎诊疗方案(试行第四版)》强调开展CRP+PCT+心肌+D—二聚体是重要筛查项目。



目前,明德生物可提供包括新型冠状病毒2019-nCoV核酸检测试剂盒在内的多种检测试剂(含CRP+PCT+心肌+D—二聚体等),助力全国抗击新型肺炎疫情。我们将与奋战在一线的医疗工作者一起筑起坚固的长城,赢得这场战役的胜利!
拓展阅读:
2019-nCoV核酸检测在疫情防控的重要价值
2020年1月12日,上海公共卫生临床中心联合武汉中心医院、华中科技大学、武汉市疾病预防控制中心、中国疾病预防控制中心、中国医学科学院、悉尼大学等多家研究机构在基因库网站GISAID联合公布了来自武汉的新型冠状病毒基因序列。新型冠状病毒2019-nCoV的基因序列公布使得各体外诊断厂商能够开发特异性分子诊断试剂,实现病毒感染早期的快速诊断,确保更好的治疗效果和病毒控制。
1月27日国家卫健委印发的《新型冠状病毒感染的肺炎诊疗方案(试行第四版)》再次强调了新型冠状病毒2019-nCoV核酸检测在疑似患者的确诊以及解除隔离和出院标准中的重要地位。随着疫情的发展,确诊检测需求的不断增加,荧光PCR法检测病毒核酸也进入了更多人的视野。
1月28日,国家卫生健康委更新了《新型冠状病毒感染的肺炎实验室检测技术指南(第三版)》进一步规范了荧光RT-PCR方法检测新型冠状病毒核酸的工作程序,保证实验结果的正确可靠。
什么是荧光RT-PCR?
PCR为Polymerase Chain Reaction的英文缩写,中文翻译为中文翻译为“聚合酶链式反应”,其技术发明者凯利·穆利斯因此于1993年获得诺贝尔化学奖。
大多数生物的遗传物质是双链DNA分子,而某些RNA病毒的遗传物质则是RNA,例如这次新冠状病毒2019-nCoV就是RNA病毒。PCR技术简单理解就是在反应管中模拟DNA在细胞中的复制过程,目的是获得最初极微量的DNA分子的大量拷贝,从而对DNA分子进行进一步的分析和研究。而针对遗传物质是RNA的病毒,可以先将RNA提取出来,用酶把RNA序列转换成DNA分子,然后再利用PCR技术获得DNA分子的大量拷贝,即RT-PCR。荧光PCR则是在原有PCR技术的基础上,通过荧光信号的强度来指示DNA的拷贝数,实现初始核酸分子含量的计算。
因为部分厂家的检测试剂主要针对新型冠状病毒2019-nCoV基因组中开放读码框1a/b(openreading frame 1ab,ORF1ab)和核壳蛋白(nucleocapsid protein,N)两个靶标进行特异性检测,因此也称为多重荧光PCR或多重荧光RT-PCR法。
新冠状病毒2019-nCoV核酸检测试剂盒通过荧光RT-PCR技术,检测病人咽拭子、鼻拭子、鼻咽抽取物、深咳痰液、呼吸道抽取物、肺泡灌洗液、血液等样本中新冠状病毒核酸的含量,如果核酸含量超过某个临界值(即阳性结果),则认为该病人被新冠状病毒感染;如果样本中核酸含量低于某个临界值(即阴性结果),则认为该病人没有被该病毒感染。
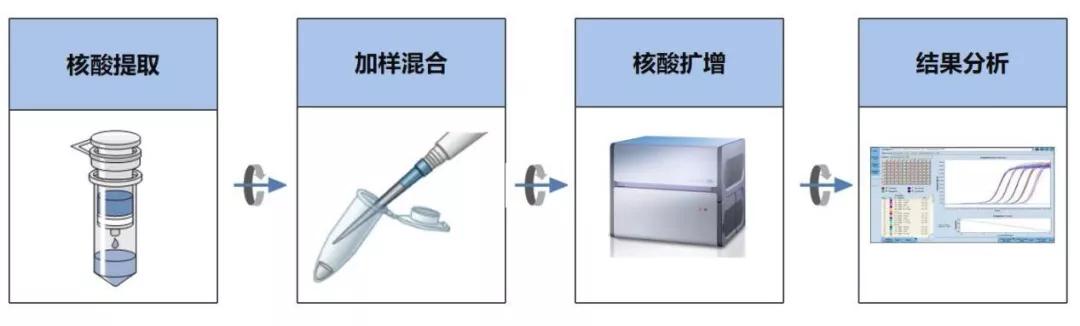
病毒核酸检测的一般流程
病毒核酸检测根据核酸提取的方式的不同一般耗时30分钟至120分钟不等、核酸扩增时间在2小时之内,而加上试剂准备、加样、结果分析等人工操作的时间,一般一次实验需要耗时4-5小时,如果考虑到样本在院内的流转时间,则从患者取样到拿到检测结果一般需要6-8小时。
1月25日湖北省医保局为保证将医疗检测项目尽早投入使用,湖北省采取先试用后申报办法,允许在医疗机构先试用,疫情解除后再按程序审核。28日开始,武汉市指定的检测机构增加为18家,同时通过国家食药监局应急审批更多的核酸检测试剂盒会获得国家食品药品监督管理总局的上市批件,正式上市。
TEL:027-87808005

Copyright © 2024 武汉明德生物科技股份有限公司版权 | 鄂ICP备12000100
互联网药品信息服务资格证书 [(鄂)-非经营性-2016-0005]
 鄂公网安备 42011502000634
鄂公网安备 42011502000634
