
C反应蛋白(CRP)是属于正五聚蛋白家族的一种急性期蛋白质,它在不同的物种进化过程中高度保守,参与全身性的炎症反应.CRP主要由肝细胞合成和释放,也有报道称CRP可能在其他部位,如巨噬细胞和平滑肌细胞局部合成和释放.
炎症反应参与了动脉粥样硬化形成的每一阶段.许多炎症标志物已经被研究应用在预测心血管疾病(CVD)中,其中CRP是一个独立的危险因子.最近的动物模型研究表明,CRP也直接参与了CVD的发病机制.除此以外,高敏C反应蛋白(hsCRP)升高伴随多种CVD危险因子,如肥胖、胰岛素抵抗,高血压,并在代谢综合征(MetS)中具有重要的预测价值.
表面健康人群血浆hsCRP浓度范围较广,实质上反映了由复杂的环境、社会人群、行为和生活方式以及肥胖和Ⅱ型糖尿病导致的个体差异.此外由双胞胎和家族研究结果估计,导致血浆hsCRP浓度表型变异的因素中,遗传因素占35%-50%.
本文综述了关于遗传多态性和各种环境因素,主要是膳食成分对血浆hsCRP基础浓度的影响及其与CVD事件风险的关系等方面的研究结果.同时讨论了CRP,即与正五聚蛋白相关的遗传多态性对降脂药物非诺贝特治疗反应的个体差异的影响.
一、CRP多态性、血浆hsCRP基础浓度与CVD事件风险的关系
本文资料来自3项研究:女性健康研究、普伐他汀炎症/CRP评价临床试验和医师健康研究,上述研究表明一组CRP单核苷酸多态性(SNPs)--包括2个启动子SNP:rs3093059和rs3091244;1个内含子SNP:rs1417938;2个外显SNP:rs1800947和2个3-UTR SNP,rs1130864和rs1205---始终与血浆hsCRP相关.Carson等在CRP基因位点周围6.8kb范围评估出7个单倍型标签SNP(包括rs309358,rs3091244,rs1417938,rs1800947,rs3093066,rs1205和rs2808630),并且根据欧美和非洲裔美国青年人的大量人群研究指出,CRP单倍型与hsCRP浓度关系密切.在这些SNP中,一个三等位基因启动子的SNP rs3091244与大部分的hsCRP变异有关.功能试验证明这个SNP位于转录子结合因子的六聚体核心.突变改变了转录子(如上游刺激因子1)结合基序,由此显著影响了CRP基因的转录活性.两个单倍型结构(由三等位基因SNP rs3091244标记)显示出高度的白细胞介素(IL)-6诱导的启动子活性,这与这两个单倍体和hsCRP浓度密切相关的发现相一致.CRP基因型和血浆hsCRP浓度的关系在其他大样本研究中,如第三次美国健康和营养(NHANESⅢ)和Framingham心脏研究也有所发现.
虽然越来越多的实验研究证明了CRP直接参与了动脉粥样硬化过程,但其因果关系仍然不能确定.得益于“孟德尔随机法则”,CRP遗传学剖析可能提供更多的证据来确定它的成因作用.这种方法与随机临床试验很相似,受孕时基因型随机分配.所以观测到的疾病与功能性遗传多态性的关联由于存在偏差混淆不易明确甚至获得反响的结果,它们可能潜在影响观测实验导致结果偏移.CRP是疾病病因的假设涉及病理学,影响CRP和成的等位基因可能调节临床CVD事件.在这点上,多个群体研究已经检测了CRP SNP对动脉粥样硬化发生的相关影响.在美国老年人中进行了心血管健康研究,随访中位数时间为13年,结果表明SNP rs1417938与白种人脑卒中和CVD死亡率升高相关,SNP rs3093058与黑种人心肌梗死风险相关,高达4倍,另两个SNP(rs1800947和rs1205)亦与白种人CVD高死亡率有关.
同时进行CVD风险评估与血浆hsCRP浓度研究.NHANESⅢ的调查人员报告指出在非西班牙裔白种人中三等位基因的SNP rs3091244与冠状动脉硬化性心脏病(CHD)交叉相关.然而这一结果尚有争议, 因为其他的包括医师健康研究,Framingham心脏研究和Rotterdam研究表明CRP基因型与心肌梗死和脑卒中关系极小或无关.这一结果的解释要考虑到许多因素.首先,CRP位点仅仅解释了hsCRP浓度变异的一小部分原因.所以有些研究可能不足以检测出疾病演变的遗传影响,尤其是小样本和相对风险度相对低的疾病.第二,年龄可能起到重要的作用,因为阳性相关更多见于老年人.第三,CRP的影响可能与疾病进展阶段有关.CRP基因型和临床CVD相关,而与颈动脉内膜中1层厚度无关,后者常用来检测临床症状不明显的冠状动脉硬化性疾病,这就表明相对于动脉粥样硬化进展,CRP更多的参与到疾病由亚临床状态向临床疾病的转变.这一发现与血浆hsCRP和颈动脉内膜中层厚度无关相一致.此外,相关性更多见于致命性的病例中,这与梗死面积增加时hsCRP浓度升高一致,这表明通过急性期反应,CRP基因型可能与疾病的严重程度关系更密切.最后,由于存在连锁不平衡性,遗传异质性,基本多效性或人群分层,利用遗传标志物作为可调工具评价因果性可能导致令人误解的结论.
简言之,当前的研究已经有力证明了CRP多态性对基础血浆hsCRP浓度的重要影响,但是尽管hsCRP是CVD的有力的独立预测指标,其与CVD风险的遗传关系意义仍不明确.就这点来说,最近创办的国际性协会,CRP CHD遗传协作研究,来自于30多个CRP基因变异和CHD风险的相关研究,将能够提出有力的证据来阐述CRP遗传性变异和CHD患者血中hsCRP浓度的因果关系.
二、CRP多态性影响hsCRP对非诺贝特降脂治疗的反应
非诺贝特,是PPAR(过氧化物酶激活受体) 拮抗剂,是贝特类降脂药物成员之一.研究和临床试验都证实了贝特类药物可以通过抗炎效应减少CVD风险,包括结构性回复和诱导CRP基因表达下调.贝特类药物治疗作用靶点是能致动脉粥样硬化的“脂质三联体”(高三酰甘油,低HDL和高LDL)和炎症.因为这两种表型都是糖尿病和MetS的重要组成并且潜在的将这两种代谢障碍与CVD联系起来,贝特类药物用作治疗与糖尿病和MetS相关的血脂障碍的备选药物,能在这两方面有效降低CVD风险.
已经证明:贝特类药物有很大个体差异,多个基因影响降脂效率.然而遗传对这些药物抗炎效应的影响还不清 楚.为了搞清这一点,在遗传降脂药物和饮食链研究中,给美国白种人群非诺贝特治疗3周,观察CRP遗传多态性对高敏C反应蛋白hsCRP的影响.这个实验由美国国立心,肺和血液研究所资助,是一种单向,非控制,非随机化干预试验,观察高脂饮食和非诺贝特治疗后由于遗传因素变化所导致三酰甘油个体差异.研究人群包括539名男性和548名女性,大多数受试者由美国国立心,肺和血液研究所正在进行的家庭心脏研究重新招募,这一研究由明尼苏达和盐湖城(Minneapolis and Salt Lake City)的两个同类基因中心管理,大部分为白种人.研究受试者的基线特征如附表1中所示,这篇综述发表在 http://www.clinchem.org/content/vol55/issue2.org/content/vol55/issue2. 上.
这篇综述与前期报道相一致,研究发现SNPsm301G>A>T(rs3091244),i178T>A(rs1417938),3u1273C>T(rs1130864),和3u2131C>T(rs1205)明显与hsCRP基础浓度相关.而且我们发现SNP m301G>A>T和il78T>A影响患有MetS的参与者hsCRP对非诺贝特干预的反应.尤其是m301G>A>T SNP C等位基因携带者能大大降低携带者hsCRP.相似的,携带il78T>A SNP的TT个体hsCRP浓度降低比携带TA和AA个体hsCRP浓度降低更明显(图1).应注意的是,这些等位基因常伴随高炎症基础状态,表明非诺贝特有较高抗炎症作用.相反,在炎性刺激下,这些等位基因如次要等位基因3u1273C>T(前期报道为1444C>T,和rs1130864,与i178T>a,rs1417938完全连锁不平衡),与接受冠状动脉搭桥手术或牙周治疗的患者hsCRP升高有更多相关性.
hsCRP
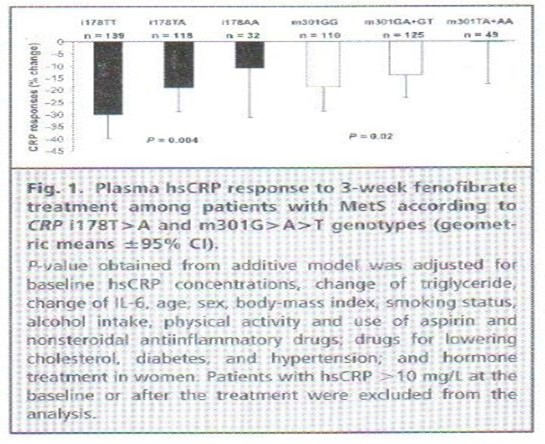
对伴Mets个体在针对非诺贝特遗传变化的调节机制仍难以确定.然而因为SNP表明与转录因子结合基序有关,某些遗传效应可能归因于这些转录因子的相互作用,尤其是携带PPAR的上游刺激因子1.我们的发现有实际价值,因为降脂药物如他汀类和贝特类药物仍然是预防CVD的关键因素.另外,虽然一系列的使用贝特类药物大样本干扰实验已经确定了其调节血脂至正常的作用,但关于它减少CVD风险的效应方面,研究结果还存在矛盾. 进一步的亚群分析显示MetS特征改变了贝特类药物对CVD的效应,也就是说心血管获益很大程度上限制在具有MetS特征的个体中.我们的数据把目光更多的投向治疗效应的不一致,认为遗传差别能够进一步区别个体对非诺贝特的反应,从而潜在的可能影响高风险个体中的疾病转归.最后,如果像很多使用他汀类药物的随机临床试验报道的那样,hsCRP浓度的减少能够直接导致CVD事件复发率下降和冠状动脉粥样硬化进展的改善,携带特定可能影响hsCRP对治疗的反应的基因型的个体,与非携带个体的心血管病转归不同,可能需要不同生活方式调节或治疗方案. 三、血浆hsCRP浓度和其他炎症标志物和遗传决定簇的关系 CRP是一个重要的下游炎症标志物,它的活性可能反映了许多上游细胞因子的活性.实验研究表明肝脏表达CRP在转录水平受到很多细胞因子调节,如IL-6、IL-1.近来有研究表明蛋白激酶C通路也与CRP调节有关,IL-8作为潜在的生理学蛋白激酶C激活剂能显著诱导肝脏CRP的释放.CRP通过诱导黏附分子表达发挥促炎症反应、激活补体系统,通过诱导纤溶酶原活化因子抑制剂1抑制纤维蛋白溶解.因为CRP和其他炎症介质间有力的生物学联系,循环中hsCRP水平与其他炎症标志物如IL-6、TNF、细胞间黏附分子1以及纤维蛋白等密切相关.其中一些炎症标志物也可以预测CVD,然而相关性远不如hsCRP显著和持久.hsCRP和其他炎症标志物相结合,为优化预测标志和增加CVD治疗靶点打开了新的思路. 理解CRP和其他炎症标志物的相互关系为寻找位于CRP位点之外的CRP遗传簇奠定了基础.迄今为止资料表明,有很多候选基因参与了CRP的调节途径,影响hsCRP的浓度.白细胞介素6(干扰素2)(IL-6)-174G/C和572C/G SNP、肿瘤坏死因子(TNF超家族成员2)(TNF)G-308A SNP和白细胞介素1(IL-1)-511C/T和3954C/T SNP都与基础hsCRP浓度相关.除了这些明显的炎症候选基因以外,其他报道与hsCRP浓度相关的位点有酪氨酸羟化酶(TH)、与CRP生成连锁的儿茶酚胺生物合成限速酶、2肾上腺素能受体、肾上腺素能1受体(ADRB1)和肾上腺素能2受体(ADRB2),以及载脂蛋白E(APOE)位点. 另外,在一个有6345名健康女性参与的女性基因组健康研究的基因组范围相关性研究中,成功分型出336 108 SNP,并且有几个新的位点与hsCRP血浆hsCRP浓度相关.这些新位点包括瘦素受体(LEPR)、白细胞介素6受体(IL6R)、葡萄糖激酶(已糖激酶4)调节因子(GCKR)和肝细胞转录因子基因HNF1同源异型盒A(HNF1A).因为这些基因与MetS、胰岛素抵抗、细胞功能和体重稳态直接相关,所以这些新的病因机制为调节血浆hsCRP和研究CRP在CVD中的作用开辟新的领域,使之既可用作有效的生物标志又是活跃的参与者. 四、环境因素和血浆hsCRP浓度的关系 以下将讨论的环境因素都能导致hsCRP的表型变异.其中以摄入膳食研究最为清楚. (一)膳食脂肪和hsCRP浓度 流行病学研究显示膳食脂肪酸的组成能够调节炎症反应.一项对护士健康研究I 组的730名女性进行的横向研究发现反式脂肪酸摄入量为最高5分位数者,比最低5分位数者的hsCRP浓度高73%.类似的研究分别来自于卫生系统专业人员随访研究(n=446,男)和NHANES参与者(1999-2000,n=4900)的次级样本,研究结果表明高脂肪,尤其是饱和和反式脂肪酸摄入,与hsCRP浓度升高相关.干预试验提供了进一步证据,证明增加的炎症反应和摄入饱和和反式脂肪酸相关.Pirro等发现在35例高胆固醇血症患者中,8周低胆固醇/低饱和脂肪酸饮食能明显降低hsCRP浓度.当健康人摄入的高脂饮食中用反式脂肪酸替代脂肪(39%脂肪)呈现相同的作用. 有人研究了n-3多不饱和脂肪酸(PUFAs)[亚麻酸(ALA)、二十碳五烯酸、二十二碳六烯酸]饮食和慢性炎症的关系.在护士健康研究I组(n=727,女)中,摄入n-3 PUFA最多的5分位数者与摄入最少5分位数者相比,其炎症标志物浓度、内皮细胞活化,hsCRP、IL-6和E-选择素均较低.此外,来自3042名希腊健康成年人的研究结果显示每周摄入至少300g鱼肉的试验者与比那些没有摄入鱼肉者hsCRP低33%.一些临床试验也证明了ALA的抗炎作用.Rallidis等发现服用ALA后,hsCRP和IL-6明显降低,然而在90名男性脂代谢障碍患者中,LA能减低胆固醇浓度却对炎症反应没有影响(ALA给药组n-6和n-3比值为1.3:1,LA给药组比值为13.2:1).此外,Bemelmans等报道在103名中度高胆固醇血症男性和女性患者中,摄入富含ALA的人造黄油者比摄入富含LA者,更能降低hsCRP浓度.流行病学研究已经证明了摄入鱼或鱼油(二十碳五烯酸和二十二碳六烯酸)和炎症生物标志物负相关,但临床实验结果并无确切结论. 一项对日本人群的单不饱和脂肪酸横向研究,包括了1556名男性和1461名女性,指出摄入油酸与hsCRP浓度负相关.另一项研究包括了180名MetS患者,无CVD患者结果显示摄入地中海式高油酸、高纤维、高抗氧化剂饮食的患者,比进食普通饮食的对照组,hsCRP、细胞因子(IL-6、IL-7和IL-18)血清浓度都低. 总的来说,现有的证据支持整体脂肪摄入量的概念;膳食中脂肪的来源和类型,尤其是饱和和反式脂肪酸、ALA和油酸;以及n-6和n-3 PUFA比值在调解hsCRP浓度和其他炎症标志物中起到重要作用. (二)碳水化合物、膳食纤维、微量营养素和hsCRP浓度 摄入碳水化合物的质量和数量通过调节血液脂质浓度和炎症反应影响CVD风险.摄入大量精制的碳水化合物,如淀粉和糖,导致餐会后血糖增高1,从而造成循环中自由基、致炎细胞因子和hsCRP浓度升高.在参与女性健康研究的18137名健康女性中,膳食血糖生成指数和膳食血糖负荷指数与hsCRP显著相关;膳食血糖生成指数和膳食血糖负荷指数在最高5分位数比最低5分位数者,hsCRP更高. 对于膳食纤维和炎症反应的关系,来自于NHANES的数据表明,在3920名成年试验者中摄入膳食纤维与血清hsCRP浓度负相关.一项包括524名对象的纵向研究显示,膳食纤维总摄入量在最高5分位数比最低5分位数人群,hsCRP升高的可能性低63%(优势比0.37,95% CI 0.16,0.87).膳食纤维可能通过减低脂肪氧化,调整肠道正常菌群和抑制高血糖素发挥抗炎效应.微量营养素(如维生素和矿物质)的抗炎效应也已有研究,有些研究证明维生素E、维生素B6、胡萝卜素和镁与血浆hsCRP浓度负相关. (三)水果、蔬菜和坚果摄入与炎症 Esmaillzadeh等报道486名德黑兰尼女性,水果和蔬菜摄入越多,患MetS的风险越低.调整年龄、体重指数和腰围后,随着每增加20%水果摄入量,平均血浆hsCRP浓度依次为1.94、1.79、1.65、1.61、和1.56mg/L,随着每增加20%蔬菜摄入量,依次为2.03、1.82、1.58、1.52、1.47mg/L.在一项随机控制的试验中包括64名不吸烟的男性,进行了4周的试验.每天摄入8份富含类胡萝卜素蔬菜和水果者比每天摄入2份者,hsCRP明显降低.水果和蔬菜的抗炎效应主要归功于其抗氧化成分.多摄入富含单不饱和脂肪酸、PUFA、精氨酸的坚果与CVD风险负相关.这种益处部分归功于炎症效应. (四)膳食结构和hsCRP浓度 除了关注个别营养素和食品种类外,还有研究关注饮食结构,它能显示更详细的营养素之间的协同效应以及与炎症调节的相互关系. 一项涉及732名健康女性的横向研究证明,审慎的膳食结构具有富含水果、蔬菜、豆类、鱼类、家禽和全谷物的特点,它与血浆hsCRP负相关.然而西方饮食特点为摄入大量的烹调过的红肉、糖果、甜点、炸马铃薯和精谷物,这与hsCRP.摄入典型审慎饮食结构者平均hsCRP为1.3mg/L,而摄入典型西方饮食结构者平均hsCRP为1.7mg/L.有趣的是,一项对180名MetS患者的随机试验发现摄入富含水果、蔬菜、坚果(274g/day) 、全谷物(103g/day)和橄榄油(8g/day)地中海类型饮食2年的患者,与审慎膳食的患者相比,如hsCRP等炎症标志物显著降低,胰岛素敏感性增加,MetS风险降低. (五)其他生活方式因素和hsCRP浓度 来自于女性健康研究27055名健康女性参与者的前瞻性研究表明,体力活动对降低CVD风险有益,除其他已知的危险因子外,这可能部分通过降低慢性炎症反应起作用.高水平的体力活动或运动训练与如hsCRP等慢性炎症标志物负相关,常见此类报导.体力活动和心肺适应性可降低hsCRP浓度6%-35%.例如,NHANES III的数据,它包括13748名参与者,研究表明与不从事任何业余体力活动的参与者相比,从事轻度、中度和重度体力活动者增加的hsCRP浓度优势比分别为0.98(95% CI 0.78-1.23),0.85(0.70-1.02),0.53(0.4-0.71).而且,体力活动的人比不活动的人表现出更低浓度的IL-6脂多糖激活产物、IL-1、TNF、TLR4和hsCRP.另外,不活动的年轻人和老年人经12周有氧和抗阻运动疗法干预,能够显著降低hsCRP浓度,甚至低至与进行体力活动的年轻人和老年人相似的水平.除了对健康人观察到的影响外,运动训练也能够明显改善患有慢性疾病如CHD和2型糖尿病患者的hsCRP. 增加体力活动的水平可以降低血浆hsCRP,其机制不仅在于影响体重,有研究证实无论低水平的体力活动,还是高水平的体重指数都与增加的炎症标志物独立相关.有人推理体力活动对粥样硬化的脂肪移动、胰岛素代谢和内皮功能具有有益的影响.其他机制还包括运动诱导的热休克蛋白释放、免疫功能调节或者减少组织缺氧. 虽然不进行体力活动作为一个CVD的危险因子还不易理解,但吸烟已经成为明确的危险因子.烟雾触发免疫反应和血管损伤,这与增加hsCRP等炎症标志物有关.一些研究证明吸烟和hsCRP浓度以及其他炎症标志物增加之间关系紧密.例如,一个关于2920名英国老年人的研究表明,与从不吸烟者相比,目前吸烟者的hsCRP浓度显著增加(2.53vs1.35mg/L).然而,大多数炎症水平在戒烟5年内得到改善,但是恢复到从不吸烟的水平要20多年的戒烟时间.NHANES III的15489名参与者研究数据证实,调整传统的CVD危险因子后,吸烟与hsCRP和纤维蛋白原相关,且为剂量依赖性的暂时性关系. 总之,影响hsCRP的饮食习惯和其他生活方式因素为预防CVD提供了新的手段.如果预防和治疗建议通过基于CRP基因的遗传信息来制定,必能更加有效.然而现在的知识还不够充分,不足以采用这种方法为临床提供建议. 五、结论 CRP位点与其他相关调节通路位点显著影响血浆hsCRP浓度.CRP遗传变异为影响CVD风险和发生提供了证据,支持CRP在动脉粥样硬化性疾病的病因学中发挥重要作用的观点.然而这些证据还不明确.另外CRP遗传变异能够影响hsCRP对降脂药物的反应,如非诺贝特,从而必然影响干预的效果.环境因素对饮食和生活方式因素也影响着hsCRP表型的个体间差异.有证据表明遗传和环境因素在这些复杂疾病中相互作用.所以,进一步明确遗传变异对饮食和其他行为矫正以及药物治疗对hsCRP反应间的关系对于建立CVD更加个性化的预防和治疗有重要的意义.
TEL:027-87808005

Copyright © 2024 武汉明德生物科技股份有限公司版权 | 鄂ICP备12000100
互联网药品信息服务资格证书 [(鄂)-非经营性-2016-0005]
 鄂公网安备 42011502000634
鄂公网安备 42011502000634
